La amenorrea es la ausencia de menstruación. Puede ser primaria, ausencia de menstruación antes de los 15 años o secundaria, ausencia de menstruación durante al menos 3 ciclos consecutivos. La causa más común de la amenorrea secundaria es el embarazo. Sin embargo, muchas amenorreas secundarias tienen origen por alguna alteración o problema que debe revertirse (SOP, disfunción tiroidea, hiperprolactinemia…).
El nombre de Amenorrea Hipotalámica Funcional (AHF) hace referencia a la ausencia de menstruación que tiene origen en el hipotálamo y es funcional, es decir, se puede revertir una vez solucionada la causa.
El término “hipotalámica”
Para que se produzca la ovulación y, por tanto, la menstruación se deben de enviar una serie de señales que viajan desde una región cerebral conocida como el hipotálamo hasta los ovarios. Es lo que se conoce como eje hipotálamo-pituitaria-gonadal.
En el hipotálamo se generan hormonas liberadoras de Gonadotropina (GnRH) en forma de pulsos. Estos pulsos de GnRH activan la liberación de gonadotropinas (LH y FSH) en la hipófisis o pituitaria. Tanto la hormona luteinizante (LH) como la hormona folículo estimulante (FSH) viajan en sangre hasta el ovario, siendo aquí donde dan la orden de liberación de andrógenos y estrógenos respectivamente.
En la AHF el eje hipotálamo-pituitaria-gonadal está inhibido. La razón es un cúmulo de factores denominados estresores:
- Actividad física excesiva
- Ingesta energética deficitaria
- Estrés psicológico
El hipotálamo deja de producir GnRH porque entiende que algo no está bien y prioriza la supervivencia a la reproducción. La AHF no es una patología sino un signo.
Alteraciones que se producen en la AHF
En la AHF la GnRH está inhibida por causa de los estresores y, por tanto, se observa un hipoestrogenismo. La falta de estrógenos a largo plazo tiene repercusión más allá de la reproducción.
- Salud ósea: los estrógenos disminuyen la tasa de remodelado óseo al disminuir el número y actividad de los osteoclastos. El déficit de estrógenos en edad fértil se asocia a aumento del riesgo de osteoporosis
- Salud cardiovascular: los estrógenos actúan sobre el endotelio y la pared arterial produciendo vasodilatación. También tienen efecto en el perfil lipídico.
- Disfunción psicológica: pueden aumentar los niveles de los neurotransmisores como serotonina, dopamina… y el número de sus receptores.
- También se observa déficit de leptina cuando el % de grasa corporal es excesivamente bajo
- Cortisol: el cortisol (la hormona del estrés) se eleva en AHF. Es frecuente que el eje hipotálamo-pituitaria-gonadal se inhiba por excesiva activación del eje hipotálamo-hipofisario-adrenal
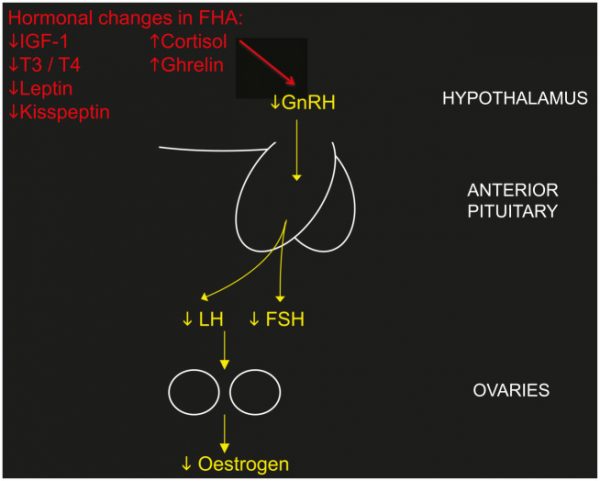
Roberts, R. E., Farahani, L., Webber, L., & Jayasena, C. (2020). Current understanding of hypothalamic amenorrhoea. Therapeutic advances in endocrinology and metabolism, 11, 2042018820945854. https://doi.org/10.1177/2042018820945854
Tratamiento
Para revertir la AHF tenemos que reducir los 3 estresores responsables de la inhibición del eje: adecuar ingesta energética y actividad física, reducir estrés y aumentar el descanso. Generalmente el eje se comienza a recuperar entre los 6-12 meses desde que se comienza el tratamiento.
En cuanto a los anticonceptivos hormonales, debemos tener en cuenta que:
- Los anticonceptivos hormonales no activan el eje, que es lo que buscamos en la AHF
- El sangrado que imita a la menstruación cuando se toman anticonceptivos hormonales no es menstruación, sino sangrado por deprivación (ver el artículo)
- Una vez se dejan de consumir, la AHF sigue ahí si no se han tratado los factores que causan el problema.
Por tanto, la primera opción de tratamiento debería ser el manejo de los estresores que afectan al hipotálamo. Así mismo, siempre debemos valorar y comentar con el profesional todas las opciones y estrategias de tratamiento que pueden ser útiles en función de cada caso.
Referencias
Gordon, C. M., Ackerman, K. E., Berga, S. L., Kaplan, J. R., Mastorakos, G., Misra, M., Murad, M. H., Santoro, N. F., & Warren, M. P. (2017). Functional Hypothalamic Amenorrhea: An Endocrine Society Clinical Practice Guideline. The Journal of clinical endocrinology and metabolism, 102(5), 1413–1439. https://doi.org/10.1210/jc.2017-00131
Shufelt, C. L., Torbati, T., & Dutra, E. (2017). Hypothalamic Amenorrhea and the Long-Term Health Consequences. Seminars in reproductive medicine, 35(3), 256–262. https://doi.org/10.1055/s-0037-1603581
Altayar, O., Al Nofal, A., Carranza Leon, B. G., Prokop, L. J., Wang, Z., & Murad, M. H. (2017). Treatments to Prevent Bone Loss in Functional Hypothalamic Amenorrhea: A Systematic Review and Meta-Analysis. Journal of the Endocrine Society, 1(5), 500–511. https://doi.org/10.1210/js.2017-00102
Roberts, R. E., Farahani, L., Webber, L., & Jayasena, C. (2020). Current understanding of hypothalamic amenorrhoea. Therapeutic advances in endocrinology and metabolism, 11, 2042018820945854. https://doi.org/10.1177/2042018820945854
Morrison, A. E., Fleming, S., & Levy, M. J. (2021). A review of the pathophysiology of functional hypothalamic amenorrhoea in women subject to psychological stress, disordered eating, excessive exercise or a combination of these factors. Clinical endocrinology, 95(2), 229–238. https://doi.org/10.1111/cen.1439.
